オートファジーのさまざまなシステム
-
オートファジーのさまざまなシステム
オートファジーとは、細胞の中で不要になったタンパク質やミトコンドリアなどの細胞内器官を分解して再利用する仕組み。ギリシャ語で「オート」は「自己」、ファジーは「食べる」という意味で、日本語では「自食作用」と訳されます。これは、酵母や植物、動物など、すべての真核生物(細胞核を有する生物)に備わっているリサイクルシステムです。
また、オートファジーが、「防御」の役割を持つことも判明しています。生物は日ごろ、さまざまな感染症のリスクにさらされていますが、それをもたらす病原菌が体内に入ってきたとき、まずは白血球などが働く免疫によって病原菌を倒します。しかし、それらをかいくぐって細胞の中に侵入してきた場合、オートファジーが、感染した細胞の有害な微生物やウイルスを分解処分するといった働きをすることも分かってきたのです。

-
さらなる研究が期待されるDNA修復機能
オートファジーには、細胞の中の古くなったり壊れたりしたたんぱく質やミトコンドリアといった、余計なものを細胞自体が除去するという、細胞内たんぱく質のクオリティコントロールの役割があることも明らかになっています。さらにその除去で集めた余計なものから、たんぱく質の材料を作り出すこともできるのです。たとえば成人男性は1日に約200gのたんぱく質を合成しているのですが、体内に取り入れるたんぱく質の量は60~80g程度。その差は、オートファジーが補っているのです。
そしてこのようなオートファジーの機能が、様々なタイプのDNA損傷の修復にも関与すると考えられてきており、今後さらなる研究が期待されています。
研究成果 · トピックス
「オートファジーのメカニズムの発見」により、大隅良典さん(東京工業大学栄誉教授)に2016年のノーベル医学・生理学賞が贈られました。オートファジーは、酵母や植物、動物など、すべての真核生物に備わっている細胞内の浄化・リサイクルシステムです。細胞内の変性タンパク質や不良ミトコンドリア、さらには細胞内に侵入した病原性細菌などを分解して浄化することで、さまざまな病気から生体を守っています。また栄養状態が悪くなったとき、過剰なタンパク質を分解して、生存に必要なタンパク質にリサイクルします。
大隅さんは1993年、酵母を使った実験により、オートファジーに欠かせない遺伝子を14種類発見し、それらの遺伝子からつくられるAtgと呼ばれるタンパク質群の機能を調べる研究を進めました。「その1993年の論文が、ノーベル賞で最も評価されたものです。現在、酵母の主要Atgタンパク質は18種類知られていますが、大隅先生はその大半を1993年に発見され、オートファジー研究の礎を築かれたのです」。微生物化学研究所の野田展生さんはそう解説します。
タンパク質の構造が分からなければ、その機能メカニズムを解明することはできません。そこで大隅さんは2001年、北海道大学の教授だった稲垣冬彦さんにAtgタンパク質の構造解析を依頼しました。その解析を担当したのが、学位を取って稲垣研究室に赴任したばかりの野田さんでした。「当時Atgタンパク質群の構造解析は1種類も行われていませんでした」。こうして野田さんたちは、世界に先駆けて、タンパク質の構造からオートファジーの仕組みに迫る研究を始めました。何でも分解できるオートファジー
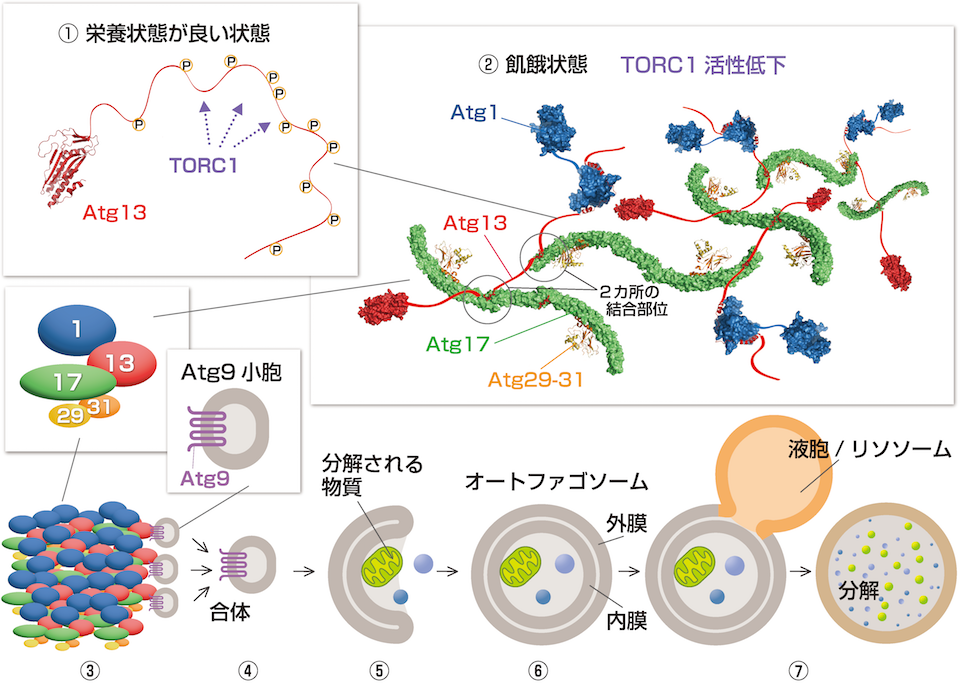
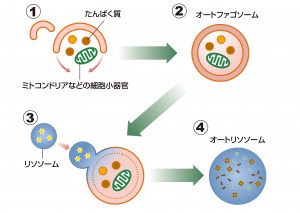
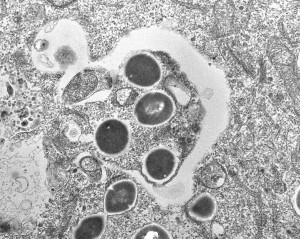
ここでオートファジーの過程を簡単に見てみましょう。オートファジーが始まるとき、まず膜で囲まれた小さな袋ができます(図④)。その袋が大きくなり、へこむように変形して分解する物質を閉じ込めます(図⑤)。この袋をオートファゴソームといい、数分から10分以内に完成します(図⑥)。そして、酵母や植物では液胞、動物ではリソソームと呼ばれる分解酵素が入った器官とオートファゴソームが融合して、物質が分解されます(図⑦)。
「オートファジーは、タンパク質や脂質だけでなくミトコンドリアなど、何でも分解することができます。ただし、分解し過ぎて細胞が死に至ることは、普通はありません。何でも分解できてしまう危険な仕組みが必要なときだけに始まり、不要なものを選択的に分解するように高度に制御されています。そこがオートファジーのすごいところです」と野田さんは言います。最初の袋ができる仕組みが分かった
野田さんと大隅さんたちは、オートファジーの仕組みを調べる共同研究を続けてきましたが、まだ分からないことがたくさんあります。その1つが、オートファゴソームがつくられる仕組みです。
野田さんと大隅さんたちは2016年、SPring-8を用いたX線結晶構造解析により、オートファゴソームができる最初の段階の仕組みを解明することに成功しました。オートファジーは、細胞が飢餓状態になったときなどに始まります。細胞内には、栄養状態のセンサーの役割をするTORC1という酵素があります。栄養状態がよいときには、TORC1がAtg13にリン酸を付け続けて、オートファジーが始まらないように抑えています(図①)。
細胞が飢餓状態になると、TORC1の活性が低下してAtg13からリン酸が外れます。するとAtg13はAtg17と結合できるようになります(図②)。
野田さんは、Atg13とAtg17が結合した複合体の構造を解析しました。「Atg13の大部分はひも状の構造で、そこに2カ所の結合部位があり、Atg13の1本のひもで2つのAtg17をつなぎとめることが分かりました。こうしてAtg13とAtg17はたくさんつながり、そこにAtg1、Atg29、Atg31も集まった巨大な複合体ができるのです」(図②〜③)。
この巨大な複合体がオートファゴソームの最初の袋をつくる土台となります。「細胞内には、Atg9を数十分子埋め込んだ膜でできた小さな袋(Atg9小胞)がたくさん漂っています。1個ずつのAtg13とAtg9の結合力はとても弱いので、普段はAtg13にAtg9小胞が集まることはありません。ところがAtg13をたくさん含む複合体ができると、そこにAtg9小胞が3個ほど結合し、Atg9小胞同士が合体してオートファゴソームの最初の袋になると考えられます」(図③〜④)。
野田さんたちは、試験管内にAtg13やAtg17が集まった複合体とAtg9小胞を混ぜて、いくつかのAtg9小胞が合体した袋ができるかどうか確かめる実験を始めています。まだ3合目
3個ほどのAtg9小胞が合体して小さな袋ができた後、そこに細胞内から膜が集まってきて、袋が大きくなります(図④〜⑤)。「どこから膜が供給されるのか、それがどのような仕組みで集まってきて袋が大きくなるのか、それはまだ謎です。そこでもAtg9が重要な働きをしていると予想されますが、その構造はまだ解析されていません。私たちはAtg9の結晶をつくり、構造解析することを目指しています」。
タンパク質の構造を解析するための代表的な手法が、結晶をつくってX線で測定するX線結晶構造解析です。ただし、Atg9のような膜タンパク質や複数のタンパク質から成る複合体は大きな結晶をつくることが難しいという問題があります。「小さな結晶しかつくれない場合も多いのですが、SPring-8ならば、そのような微小結晶でも構造解析ができます」。
オートファジーには、さらに大きな謎が残されています。「その一つは、分解する物質を閉じ込めるために、袋が大きくへこむように変形する仕組みです。その変形でもAtg9が関係しているかもしれません」。
完成したオートファゴソームは内膜と外膜の2層構造になります(図⑥)。「液胞やリソソームに融合すると、内膜は閉じ込めた物質とともに分解されます。しかし外膜は分解されずに、液胞やリソソームの膜の一部となります(図⑦)。なぜ、内膜だけが分解されるのか、それも大きな謎です。大隅先生はオートファジー解明の道のりは、まだ3合目だとおっしゃっています」。緊密な共同研究で10合目を目指す
「構造解析を進める研究者は、ある現象で働くタンパク質を解析したら、次はまったく別の現象のタンパク質を対象にする人も多いようです。私はオートファジーに関わるタンパク質にターゲットを絞って構造解析を進めてきました。オートファジーは1種類のタンパク質の構造を解いただけでは現象の仕組みが分からない巨大システムです。たくさんのタンパク質の構造を解析することで、ようやくオートファジーの仕組みの一端が見えてきます。そこが、大変ですが、面白いところです」。
生命現象の仕組みを解明するには、大隅さんのように、現象に関わる遺伝子・タンパク質を突き止めてその機能を調べる“機能解析”と、野田さんのように、タンパク質の構造を解析して機能メカニズムを調べる“構造解析”の両方が必要です。
野田さんは、大隅さんとの共著論文が最も多い研究者です。「私は2011年に北海道大学から微生物化学研究所(東京都)に移った後は、東京工業大学の大隅研究室(神奈川県)のセミナーに毎週、参加しています。機能解析と構造解析の研究者による、このような緊密な共同研究は、ほかに例がないと思います」。
オートファジーは、がんやパーキンソン病などさまざまな病気や、老化とも関係が深いことが分かってきました。野田さんは、ヒトやマウスなど哺乳類のオートファジーの研究を進めている水島昇さん(東京大学大学院教授)との共同研究も行っています。
「私は薬学部の出身で創薬などの応用研究にも興味がありました。ただし現在は、質の高いサイエンスを進めれば、おのずと応用につながると考え、オートファジーの仕組みに迫る基礎研究を進めています」。生物の生存に不可欠な現象
iPS細胞などの再生医療と同様、世界中の研究者がしのぎを削る、ホットな研究分野が「オートファジー」だ。日本語では「自食作用」と訳され、細胞の中で行われるリサイクル・システムを指す。がんやアルツハイマー病といった病気の解明・治療にもつながると期待され、その研究はノーベル賞級ともいわれる。しかも、リードしているのは日本の研究者たちだ。大阪大学の吉森先生もその一人。吉森先生と一緒に、さまざまな生物に共通した「根源的な生命現象」の謎に迫ってみよう。
オートファジーと聞いても、中学生や高校生には「?」でしょうね。それもそのはず、細胞生物学を専門とする人たちの間ですら、広く知られるようになったのは最近のことですから。私が研究を始めた17~18年前には、「ジショク作用? 吉森さん研究を辞めるんですか?」なんて真顔で言われたものです(笑)。ところが、21世紀に入って状況が一変。1990年代の半ばまで世界で年に数十本しかなかった研究論文の数が、いまは優に3000本を超えるようになりました。しかも、日本が研究をリードしているんです。
これほどまで注目されるようになったのは、オートファジーが生物の生存に極めて重要な役割を果たしていること、そして、多くの病気と密接に関係していることがわかってきたからです。
オートファジーの「オート」は「自己」で、ファジーは「食べる」(どちらもギリシャ語)。ごくごく簡単に言うと、細胞の中の余計なものを細胞自体が取り除くシステムです。不思議なことに、小さな掃除機のような器官が突然現れ、細胞の中を掃除する! そう、まさに突然、何もないところから掃除機が現れるんですよ。古くなったり壊れたりしたたんぱく質やミトコンドリアといった細胞内の小器官は、これにより除去されます。さらにオートファジーがすごいのは、集めた“ゴミ”からたんぱく質の材料を作り出すところです。成人男性は1日に約200gのたんぱく質を合成しているのですが、体内に取り入れるたんぱく質の量は60~80gしかありません。その差は、オートファジーが補っているんです。
では、どんな現象なのか、下の図を使って説明しましょう。
最初に、細胞の中に扁平な二重の膜が現れます(=①)。「扁平な二重の膜」ではわかりにくいかもしれませんね。お椀のような形をした空気が抜かれたサッカーボールをイメージしてください。これが掃除機にあたるもので、ミトコンドリアなどの細胞内小器官や古くなったたんぱく質を包み込んでいきます(=②)。完全に包み込み、丸い袋状になったものは「オートファゴソーム」は呼ばれ、直径約1μm(マイクロメートル=1mの100万分の1)の大きさです。ちなみに、最初の扁平な二重の膜がどこから現れるのかは、最近までよくわかっていませんでした。また、包み込むものも、選択している場合と選択していない(=無作為)場合があって、ここにも多くの謎が残されています。図に戻りましょう。今度は下の段を見てください。
先のオートファゴソームに小さな丸いものが近づいていますよね。「リソソーム」という器官で、そこにはたくさんの種類の分解酵素が入っています。これが、オートファゴソームにくっついて融合(=③)。一体となった袋状の「オートリソソーム」の中で、分解酵素がたんぱく質や細胞内小器官をアミノ酸などに分解します(=④)。そうやってできたアミノ酸などが袋の外に出て、細胞内の工場のような場所で、新しいたんぱく質に合成しなおされるのです。
上の一連の流れは、最近の研究で明らかになってきたのですが、細胞の中で成分の一部が分解されているらしいことは、1950年代から知られていました。ベルギーの研究者がオートファジーと命名したのも約50年前の話で、そのあと電子顕微鏡を使った研究で掃除機にあたるオートファゴソームや、オートファゴソームがリソソームと融合している様子なども観察されています。しかし、メカニズムを解明する手がかりとなる遺伝子が見つからなかったため、なかなか研究が進みませんでした。日本の研究で謎の解明が一気に進んだ
オートファジーは当初、「細胞が飢餓状態に陥ったとき、自らの一部を分解し栄養に変える仕組みだ」と考えられていた。そのため、「自食」という名前がついたのだが、この「飢餓に対応する」ことに加え、先述したように細胞内の「浄化」の役割があることも明らかになってきた。また、「防御」の役割を持つことも判明している。こうした大きな発見がもたらされたのには、「オートファジーの父」と呼ばれる大隅良典先生(現・東京工業大学特任教授)の功績が極めて大きい。大隅先生は1993年までに14個の関連遺伝子を発見、それを機に、劇的に研究は進んでいくのだった。
大隅先生がオートファジーの謎を解明するきっかけをつかんだのは先生が東京大学の助教授のとき、1988年のことでした。ある日、いつものようにご自身が専門にしている酵母(出芽または分裂により増殖する菌類。お酒やパンに使われるのもその一種)を、顕微鏡を使って観察していたところ、ピチピチ飛び跳ねる小さな粒がたくさん見えた。「いったいこれは何?」。不思議に思った先生は、直感的にオートファジーに関係しているのではないか? と考えたそうです。というのも、酵母を飢餓状態においたときに見えた現象だからでした。
実際、そのとおりで、大隅先生は観察と実験を重ね、この現象がオートファジーによるものであることを突き止めます(跳ねていたのは、図の②のオートファゴソーム)。さらに、人工的に突然変異を起こした酵母を、手当たり次第調べることで、オートファジーに関係する遺伝子を次々と発見していきます。現在、30種類以上の関連遺伝子が発見されていますが、そのうち最も重要な14種を大隅先生が見つけました。こうした功績で大隅先生は、現在、ノーベル賞の有力候補に上がっています。
ただ、論文が発表された1993年当時、この“大発見”はほとんど注目を集めていません。96年に大隅先生は東大から愛知県岡崎市の基礎生物学研究所に移られ、そのとき、私も助教授として大隅先生と一緒にオートファジーを研究することになったのですが、先ほど言ったように、論文発表から3年経っても「自食」を「辞職」に間違えられるといった状態。それが変わったのは、大隅先生と私、さらに水島昇さん(現・東京大学教授)も加わって、発見された遺伝子をテコに、メカニズムや「浄化」の役割など、さまざまな謎や現象を明らかにしたからです。とくに、哺乳類でオートファジーに関係する遺伝子を見つけたことが決定的になりました。
いまでは、オートファジーが真核生物(細胞核を有する生物)に共通する生命現象であることがわかっています。基本的な仕組みは同じで、酵母の遺伝子と人間のそれもほぼ一緒。酵母で見つかった遺伝子はすべて、私たち人間も持っています。要するに、酵母や菌類から植物、昆虫、魚類、哺乳類まですべての真核生物に不可欠なもので、それがなければ死んでしまうわけです。
その後の研究で、オートファジーと病気との関連も明らかになってきました。
たとえば、神経にかかわる病気。神経細胞は他の細胞と違って分裂をしません。そのため細胞の中にゴミがたまりやすいのですが、オートファジーが働かず異常なたんぱく質などが蓄積されると、アルツハイマー病やパーキンソン病といった病気になってしまうんです。神経性疾患はオートファジーと極めて深い関係がある、と考えて間違いありません。
その他にも、糖尿病や動脈硬化、痛風、がん、クローン病などを、オートファジーによる「細胞内の清掃」が防いでいることがわかってきました。このうち、がんに関してはオートファジーの「働き過ぎ」も重要です。がんは飢餓状態に陥りやすい細胞なのですが、オートファジーが活発でどんどん栄養をつくり出せばなかなか死んでくれない。放射線や抗がん剤を使った治療を行ったとしても、自己修復して生き残ってしまうのです。
逆に言えば、オートファジーの働きを抑える薬があれば、がんに罹った患者さんの治療に使えます。一方、アルツハイマー病などはオートファジーを促す薬で症状を抑えることが可能になります。がんも予防に関しては「オートファジーの促進」のほう。このように病気とオートファジーの関係が明らかになったことで、治療に向けた創薬が世界中で行われるようになりました。(オートファゴソームが侵入した病原菌を包み込む)
謙虚な気持ちが世紀の発見をもたらす
「いまでも夢のような気分です」――。「こんなすごい研究に携わることができて、どのようなお気持ちですか?」という質問に対しての、吉森先生の答えだ。吉森先生が、大隅先生の研究室に誘われた際は、まだ「興味深いテーマだな」程度の認識だった、という。しかし、持ち前の好奇心と探究心で研究を行った結果、次々と画期的な発見を生み出した。大隅先生と一緒に、吉森先生や水島先生をノーベル賞候補に挙げる外国の新聞もあるくらいだ。「オートファジーはまだまだわからないことだらけなんです」と語る吉森先生。いまも残った謎の解明と、薬の開発に取り組んでいる。
少しだけですが私の研究についてもお話しておきましょう。先ほど、オートファジーには「防御」の役割があるという話が出ましたが、私が最初にそれを突き止めました(2004年、アメリカの科学雑誌『サイエンス』に発表)。
生物は、さまざまな感染症の危険に晒されていますが、それをもたらす病原菌が体内に入ったときどうするか。まずは、白血球などが働く免疫によって病原菌をやっつけます。しかし、攻撃をかいくぐって細胞の中に侵入するものもいる。実は、それらにもオートファジーが働くことがわかったんです。具体的には、細胞膜の一部がくぼんで侵入しようとする病原菌を取り込みます。できたくぼみは細胞膜から切り離され小胞(小さな袋のようなもの)となります(このとき小胞は細胞の中に)。すると、扁平な二重の膜が出現し小胞を取り囲み・・・・・・ここからは先の図と同じで、最終的に病原菌は分解酵素によりバラバラになります。
詳しくは述べませんが、この研究を進めたことで、どうやって細胞は病原菌を探知するかがわかりました。また、「扁平な二重の膜がどこでつくられているのか」という大きな謎の解明も最近果たすことができました(2013年、イギリスの科学雑誌『ネイチャー』に発表)。とはいえ、解明された謎はまだほんの一部でしかありません。知りたいことはたくさんあるし、薬の開発にも力を入れたい。いま取り組んでいる糖尿病など生活習慣病とオートファジーの関係の研究も進めなくてはいけません。
こんなにエキサイティングな研究テーマに出会えたのですから、本当に私はラッキーでしたねぇ。
さて、「そんな、すごいテーマを見つけるコツを教えてください」といった質問を受けることもあるのですが、私は「運やタイミングだけではない」と考えています。おそらく、一番大切なのは謙虚な気持ち。大隅先生が、最初に酵母で不思議な現象を見たときも、いままでの常識にとらわれていたら、オートファジーには結び付けられなかったはずです。世紀の大発見というのは、「狙っていたのはAだけど、Bといった現象が現れた。これは何?」から始まることが多いんですよ。謙虚な気持ちで、地道に粘り強く観察を続けたからこそ、大きな発見につながったのでしょうね。
ですから、みなさんも不思議な現象を見かけたら、まずはじっと観察してみてください。そして、「これは何なんだろう?」と好奇心をもってあれこれ考えてみましょう。そう、今度は、みなさんが新しい発見をする番です。